 Pengukuran dan Angka yang Beraneka-ragam.
Pengukuran dan Angka yang Beraneka-ragam.
Saudara sudah mempelajari tentang cara-cara pengukuran penting di laboratrium dan sistim satuan.
Dalam melakukan pengukuran biasanya selalu memperhatikan dua hal , yaitu :
- Ukuran kuantitatifnya ,yaitu dari satuan yang digunakan.
- Berapa besar ukuran yang digunakan dapat dipercaya.
Bila kita mengukur ,kita menjumpai angka dengan cara membacanya dari skala yang digunakan untuk mengukur benda tersebut . Oleh sebab itu , hampir selalu kita berhadapan dengan keterbatasan mengenai arti angka yang diperoleh.
Untuk lebih memahami mengenai Angka penting , berikut penjelasan mengenai angka penting . Dengan adanya penjelasan ini semoga pembaca bisa membedakan dan mengerti apa itu angka penting .
Angka Penting
Semua angka yang diperoleh dari hasil pengukuran disebut ANGKA PENTING, terdiri atas angka-angka pasti dan angka-angka terakhir yang ditaksir ( Angka taksiran ). Hasil pengukuran dalam fisika tidak pernah eksak, selalu terjadi kesalahan pada waktu mengukurnya.
Kesalahan ini dapat diperkecil dengan menggunakan alat ukur yang lebih teliti.
- Semua angka yang bukan nol adalah angka penting. Contoh : 14,256 ( 5 angka penting ).
- Semua angka nol yang terletak di antara angka-angka bukan nol adalah angka penting. Contoh : 7000,2003 ( 9 angka penting ).
- Semua angka nol yang terletak di belakang angka bukan nol yang terakhir, tetapi terletak di depan tanda desimal adalah angka penting.Contoh : 70000, ( 5 angka penting).
- Angka nol yang terletak di belakang angka bukan nol yang terakhir dan di belakang tanda desimal adalah angka penting.Contoh : 23,50000 ( 7 angka penting ).
- Angka nol yang terletak di belakang angka bukan nol yang terakhir dan tidak dengan tanda desimal adalah angka tidak penting.Contoh : 3500000 ( 2 angka penting ).
- Angka nol yang terletak di depan angka bukan nol yang pertama adalah angka tidak penting.Contoh : 0,0000352 ( 3 angka penting ).
Ketentuan – Ketentuan Pada Operasi Angka Penting :
1. Hasil operasi penjumlahan dan pengurangan dengan angka-angka penting hanya boleh terdapat SATU ANGKA TAKSIRAN saja.
Contoh : 2,34 angka 4 taksiran
0,345 + angka 5 taksiran
2,685 angka 8 dan 5 ( dua angka terakhir ) taksiran.
maka ditulis : 2,69
( Untuk penambahan/pengurangan perhatikan angka dibelakang koma yang paling sedikit).
13,46 angka 6 taksiran
2,2347 – angka 7 taksiran
11,2253 angka 2, 5 dan 3 ( tiga angka terakhir ) taksiran
maka ditulis : 11,23
2. Angka penting pada hasil perkalian dan pembagian, sama banyaknya dengan angka penting yang paling sedikit.
Contoh : 8,141 ( empat angka penting )
0,22 x ( dua angka penting )
1,79102
Penulisannya : 1,79102 ditulis 1,8 ( dua angka penting )
1,432 ( empat angka penting )
2,68 : ( tiga angka penting )
0,53432
Penulisannya : 0,53432 di tulis 0,534 ( tiga angka penting )
3. Untuk angka 5 atau lebih dibulatkan ke atas, sedangkan angka kurang dari 5 dihilangkan.
CONTOH 1.1
Sekelompok siswa yang melakukan pengukuran massa benda menggunakan alat neraca pegas. Dalam pengukuran itu terlihat penunjukkan skala seperti pada Gambar 1.2. Aghnia menuliskan hasil 8,85 gr sedangkan John menuliskan hasil 8,9 gr. Manakah hasil yang benar?
Penyelesaian:
Coba kalian perhatikan Gambar 1.2. Dari gambar itu dapat diperoleh:
Angka pasti = 8 gr
Angka taksiran = 0,9 gr (hanya boleh satu angka taksiran, tidak boleh 0,85 karena 2 angka taksiran)
Hasil pengukuran adalah
m = angka pasti + angka taksiran
= 8 + 0,8 = 8,8 gr
Jadi yang lebih tetap adalah hasilnya John.

Untuk lebih memahami contoh ini dapat kalian coba soal berikut.
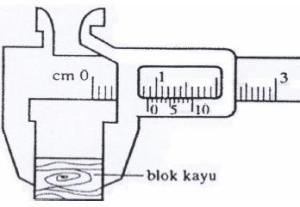
Sebuah pensil diukur panjangnya dengan mistar centimeter. Keadaannya dapat dilihat seperti pada Gambar 1.3. Tentukan hasil pengukuran tersebut.

Kesimpulan , dengan adanya angka penting mengenai bilangan yang bermakna ini dapat menunjukan kepada kita pengukuran yang dapat dipercaya.
 Metode potensiometri didasarkan atas pengukuran selisih atau beda potensial antara dua buah electrode yang tercelup dalam larutan. Proses titrasi potensiometri dapat dilakukan dengan bantuan elektroda indikator dan elektroda pembanding yang sesuai. Dengan demikian, kurva titrasi yang diperoleh dengan menggambarkan grafik potensial terhadap volume pentiter yang ditambahkan, mempunyai kenaikan yang tajam di sekitar titik kesetaraan. Dari grafik itu dapat diperkirakan titik akhir titrasi. Cara potensiometri ini bermanfaat bila tidak ada indikator yang cocok untuk menentukan titik akhir titrasi, misalnya dalam hal larutan keruh atau bila daerah kesetaran sangat pendek dan tidak cocok untuk penetapan titik akhir titrasi dengan indikator (Rivai, 1995).
Metode potensiometri didasarkan atas pengukuran selisih atau beda potensial antara dua buah electrode yang tercelup dalam larutan. Proses titrasi potensiometri dapat dilakukan dengan bantuan elektroda indikator dan elektroda pembanding yang sesuai. Dengan demikian, kurva titrasi yang diperoleh dengan menggambarkan grafik potensial terhadap volume pentiter yang ditambahkan, mempunyai kenaikan yang tajam di sekitar titik kesetaraan. Dari grafik itu dapat diperkirakan titik akhir titrasi. Cara potensiometri ini bermanfaat bila tidak ada indikator yang cocok untuk menentukan titik akhir titrasi, misalnya dalam hal larutan keruh atau bila daerah kesetaran sangat pendek dan tidak cocok untuk penetapan titik akhir titrasi dengan indikator (Rivai, 1995). Metode potensiometri didasarkan atas pengukuran selisih atau beda potensial antara dua buah electrode yang tercelup dalam larutan. Proses titrasi potensiometri dapat dilakukan dengan bantuan elektroda indikator dan elektroda pembanding yang sesuai. Dengan demikian, kurva titrasi yang diperoleh dengan menggambarkan grafik potensial terhadap volume pentiter yang ditambahkan, mempunyai kenaikan yang tajam di sekitar titik kesetaraan. Dari grafik itu dapat diperkirakan titik akhir titrasi. Cara potensiometri ini bermanfaat bila tidak ada indikator yang cocok untuk menentukan titik akhir titrasi, misalnya dalam hal larutan keruh atau bila daerah kesetaran sangat pendek dan tidak cocok untuk penetapan titik akhir titrasi dengan indikator (Rivai, 1995).
Metode potensiometri didasarkan atas pengukuran selisih atau beda potensial antara dua buah electrode yang tercelup dalam larutan. Proses titrasi potensiometri dapat dilakukan dengan bantuan elektroda indikator dan elektroda pembanding yang sesuai. Dengan demikian, kurva titrasi yang diperoleh dengan menggambarkan grafik potensial terhadap volume pentiter yang ditambahkan, mempunyai kenaikan yang tajam di sekitar titik kesetaraan. Dari grafik itu dapat diperkirakan titik akhir titrasi. Cara potensiometri ini bermanfaat bila tidak ada indikator yang cocok untuk menentukan titik akhir titrasi, misalnya dalam hal larutan keruh atau bila daerah kesetaran sangat pendek dan tidak cocok untuk penetapan titik akhir titrasi dengan indikator (Rivai, 1995).










